2. MICRO-ALGHE
Peter Coutteau
Laboratory of Aquaculture & Artemia Reference Center
University of Gent, Belgium
2.1 Introduzione
Il fitoplancton è la base della catena alimentare nel ambiente marino. Perciò le micro-alghe sono indispensabili nel allevamento commerciale di animali marini in quanto costituiscono la principale risorsa di cibo per tutti gli stadi di crescita di molluschi bivalvi, fasi larvali di alcune specie di crostacei e delle primissime fasi di crescita di molte specie di pesci. Le alghe sono inoltre usate per produrre un’enorme quantità di zooplancton (rotiferi, copepodi, artemia), che serve a sua volta come cibo per le larve e i primi stadi di crescita di pesci e crostacei. Oltretutto, per l’allevamento delle larve di pesci marini, secondo la “tecnica dell’acqua verde”, le alghe sono usate direttamente nelle vasche assieme alle larve, in quanto si ritiene che abbiano un ruolo importantissimo nella stabilizzazione della qualità dell’acqua, nutrimento delle larve e controllo microbico.
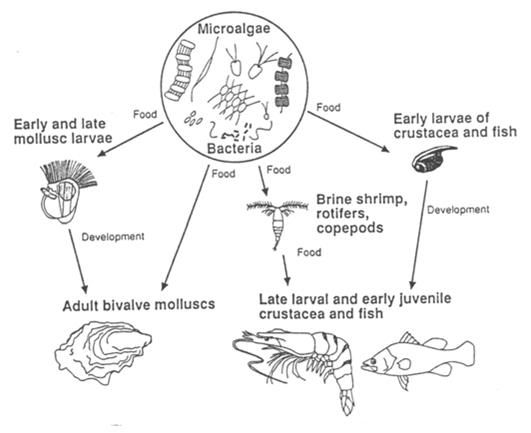 Figura 2.1. Il ruolo centrale delle micro-alghe nell’acquacoltura marina.
Figura 2.1. Il ruolo centrale delle micro-alghe nell’acquacoltura marina.
Non tutte le specie algali sono ugualmente efficaci nel supporto della crescita e sopravvivenza di particolari animali filtratori. Le specie più adatte sono selezionate in base al potenziale di coltura di massa, grandezza delle cellule, digeribilità e sui valori nutrizionali necessari al nutrimento dell’animale. Svariate tecniche hanno permesso di portare l’allevamento di queste specie di cibo su larga scala, partendo da una coltura estesa e scarsamente controllata ad una intensiva e mono-specie. Una possibile alternativa alla coltura algale in loco, è la raccolta di alghe dall’ambiente naturale dove, grazie a determinate condizioni, può essere davvero abbondante. Tuttavia, provando a superare o ridurre i problemi e limitazioni legati alle colture algali, vari ricercatori hanno tentato di sostituire le alghe con diete artificiali; questi vari aspetti della produzione, uso e sostituzioni di micro-alghe in acquacoltura, saranno trattati successivamente in questo capitolo.
2.2. Le principali classi e generi di specie algali coltivate.
Oggi, più di 40 differenti specie di micro-alghe in varie parti del mondo, sono coltivate singolarmente con sistemi intensivi. La tabella 2.1. elenca le 8 principali classi e i 32 generi di alghe coltivate ed attualmente usate per alimentare gli svariati gruppi di organismi acquatici in commercio. La lista include specie di diatomee, flagellati e alghe verdi clorococcali, alghe verde-blu filamentose, partendo dalle dimensioni di pochi micron a più di 100 μm.
Le specie più usate nell’acquacoltura marina commerciale sono le diatomee Skeletonema costatum, Thalassiosira pseudonana, Chaetoceros gracilis, C. calcitrans, i flagellati Isochrysis galbana, Tetraselmis suecica, Monochrysis lutheri e le clorococcali Chlorella spp. (Fig. 2.2.).
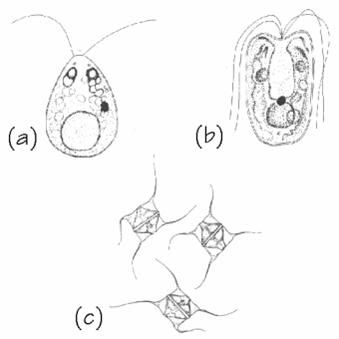 Fig. 2.2. Alcuni tipi di alghe marine usate come cibo in acquacoltura: (a) Tetraselmis spp. (b) Dunaliella spp. (c) Chaetoceros spp.
Tabella 2.1. Principali classi e generi di micro-alghe coltivate in acquacoltura
Fig. 2.2. Alcuni tipi di alghe marine usate come cibo in acquacoltura: (a) Tetraselmis spp. (b) Dunaliella spp. (c) Chaetoceros spp.
Tabella 2.1. Principali classi e generi di micro-alghe coltivate in acquacoltura
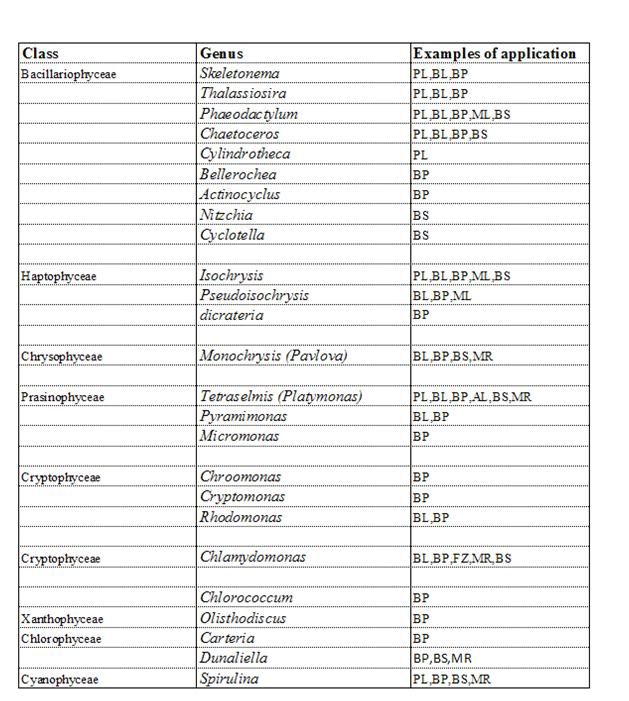
Legenda: PL, gamberi peneidi; BL, larve di molluschi bivalvi; ML, larve di gamberetti d’acqua dolce; BP, post-larve di molluschi bivalvi; AL, larve di orecchie di mare; MR rotiferi marini (Brachionus); BS, Artemia; SC, copepodi d’acqua salata; FZ, zooplancton d’acqua dolce
2.3. Produzione Algale
2.3.1. Condizioni chimiche e fisiche
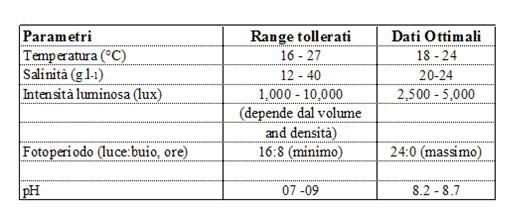
I parametri più importanti che regolano la crescita algale sono: quantità e qualità dei nutrienti, luce, pH, movimento, salinità e temperatura. I parametri ottimali e i range tollerati dalle specifiche specie sono elencati nella Tabella 2.2. I vari fattori possono essere indipendenti e i parametri che sono ottimali per un tipo non lo sono necessariamente per un altro.
2.3.1.1. Materiale di coltura / nutrienti
La concentrazione di cellule nelle colture di fitoplancton sono generalmente più alte di quelle che si possono trovare in natura. Le colture algali devono essere arricchite con nutrienti per sopperire alle mancanze dell’acqua salata. I macro-nutrienti sono costituiti da nitrati, fosfati (approssimativamente in un rapporto 6:1) e silicati.
Tabella 2.2. Condizioni generali per la coltura di micro-alghe
I silicati sono specificatamente usati per la crescita delle diatomee che utilizzano questo composto per la produzione del guscio esterno.
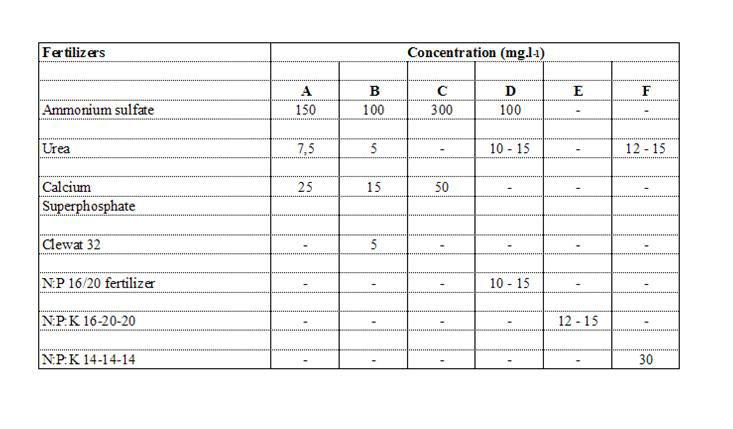
I micro-nutrienti sono costituiti da: tracce di metalli vari, vitamina B1, B12 e a volte B8. Due prodotti d’arricchimento che vengono utilizzati principalmente e che sono adatti alla crescita di gran parte delle alghe sono il Walne (Tabella 2.3.) e il Guillard F/2 (Tabella 2.4.) Diverse ricette specifiche per i prodotti di coltura sono descritti da Vonshak; le soluzioni di nutrienti commercialmente disponibili posso tuttavia ridurre di molto il lavoro di preparazione. La complessità e il costo dei prodotti per la coltura fanno escludere il loro uso per le colture di larga scala.. Degli arricchitori alternativi, adatti la produzione di massa di micro-alge in sistemi estensivi in larga scala, contengono solamente i nutrienti più essenziali e sono composti da fertilizzanti ad uso agricolo (anziché di laboratorio).
Tabella 2.3. Composizione e preparazione del prodotto Walne
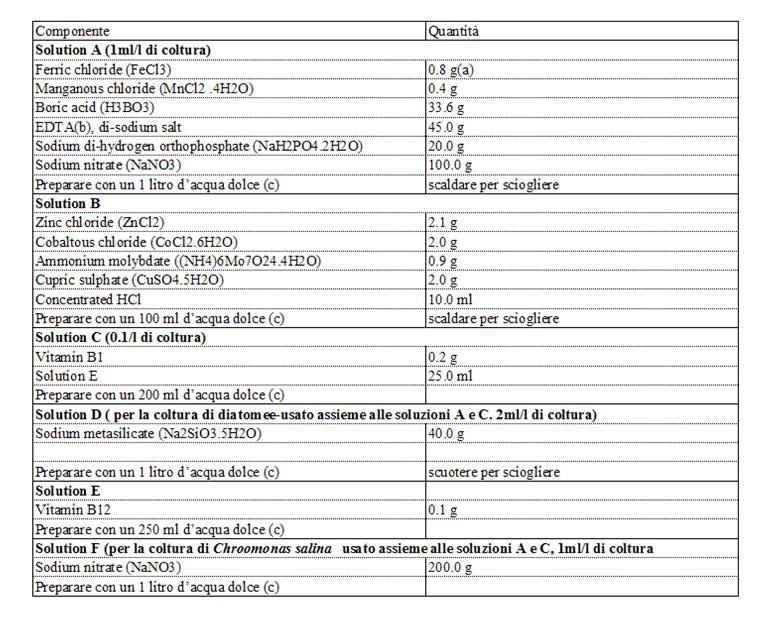
N.B.
(a) Usare 2.0 g per la coltura di Chaetoceros calcitrans in acqua di mare filtrata; (b) Ethilene diamine tetra acetic acid; (c) Usare preferibilmente acqua distillata
Tabella 2.4. Composizione e produzione del prodotto Guillard f/2
 Tabella 2.5. Varie combinazioni di fertilizzanti che possono essere utilizzati per la coltura di massa di alghe marine
Tabella 2.5. Varie combinazioni di fertilizzanti che possono essere utilizzati per la coltura di massa di alghe marine
 2.3.1.2. Luce
2.3.1.2. Luce
Come tutte le piante, le micro-alghe utilizzano la fotosintesi: assimilano carbonio inorganico convertendolo in materia organica. La luce è la risorsa di energia che permette questa reazione e pertanto l’intensità, la qualità dello spetto e il fotoperiodo vanno assolutamente considerati. L’intensità luminosa ha un ruolo importante, ma le necessità variano sensibilmente dalla profondità e dalla densità della coltura algale: ad alte profondità e concentrazioni cellulari, l’intensità deve essere sufficientemente potente da penetrare attraverso la coltura (1'000 lux è adatta per un fiasco Erlenmeyer, 5’000-10'000 lux per volumi più grandi). La luce deve essere naturale o fornita da tubi fluorescenti. Un’eccessiva intensità luminosa (sole diretto, piccolo contenitore vicino a luce artificiale) potrebbe provocare una foto-inibizione. Inoltre il surriscaldamento, sia causato dalla luce naturale che artificiale, va evitato. Si preferiscono i tubi fluorescenti che emettono sia uno spettro blu che rosso in quanto emettono le porzioni di spettro luminoso che meglio attivano la fotosintesi. La durata del fotoperiodo artificiale deve essere al minimo di 18h di luce al giorno, anche se per coltivare il fitoplancton solitamente viene fornita illuminazione costante.
2.3.1.2 pH
Il range di pH utilizzato per la maggior parte delle alghe coltivate varia da 7 a 9, con un’oscillazione ottimale compresa tra l’8,2 e l’8,7. Un collasso completo della coltura dovuto all’interruzione dei processi cellulari può essere causato dallo scorretto mantenimento del pH. Ciò può essere evitato aerando la coltura (vedi sotto). In caso di un’alta densità algale, l’introduzione della CO2 permette di correggere l’innalzamento del pH, che può raggiungere e superare il valore limite di pH 9
2.3.1.4. Aerazione/mescolamento
Il mescolamento è necessario per: prevenire la sedimentazione delle alghe, assicurare che tutte le cellule della popolazione siano equamente esposte alla luce e ai nutrienti, per evitare la stratificazione termica (nelle colture all’aperto) e per migliorare lo scambio gassoso nel materiale di coltura. Quest’ultimo è di primaria importanza in quanto l’aria contiene il carbonio (in forma di CO2) necessario alla fotosintesi. Per colture ad alta densità, la scarsa CO2 introdotta dalle bolle d’aria (contengono lo 0,03% di CO2) limita la crescita algale pertanto oltre l’aerazione deve essere introdotta anche della CO2 pura (1% del volume d’aria). Inoltre il dosaggio dei CO2 tampona l’oscillazione del pH grazie all’equilibrio anidride carbonica/carbonati. A seconda della grandezza del sistema di coltura, il mescolamento va fatto a mano giornalmente (provette, fiaschi erlenmeyer ), o con aerazione (vasche, sacchi) o usando pale rotanti e pompe (laghetti). Tuttavia va considerato che non tutte le specie algali tollerano mescolamenti vigorosi.
2.3.1.5. Temperatura
La temperatura ottimale per la coltura di fitoplancton va generalmente dai 20° ai 24°, anche se questo dipende dalla composizione del materiale di coltura e la specie coltivata. Le specie più comunemente coltivate di micro-alghe tollerano temperature comprese tra i 16° e i 27°; temperature inferiori ai 16° rallentano la crescita invece temperature superiori ai 35° sono letali per tutte le specie. Se necessario, le colture vanno raffreddate con flussi d’acqua fredda sulla superficie dei contenitori o controllando la temperatura dell’ambiete con l’aria condizionata.
2.3.1.6. Salinità
Il fitoplancton marino è estremamente tollerante ai cambi di salinità. Molte specie crescono meglio a salinità leggermente inferiori rispetto a quelle dei loro habitat naturali; Salinità di 20 – 24 g/l sono considerate ottimali.
2.3.2. Dinamiche di crescita
La crescita di una coltura axenica di micro-alghe è caratterizzata da cinque fasi (Figura 2.3.):
1) ritardo o fase d’induzione: Questa fase, durante la quale avviene un piccolo incremento della densità, è relativamente lungo quando una coltura è trasferita dalle piastre alla coltura liquida. Le colture inoculate con alghe aventi una crescita esponenziale, hanno una fase d’induzione breve, che riduce drasticamente il tempo necessario per evolvere. Il ritardo della crescita è attribuito all’adattamento fisiologico delle cellule alla crescita e all’aumento dei livelli enzimatici e metaboliti necessari alla divisione cellulare e al fissaggio del carbonio.
Figura 2.3. Le Cinque fasi di crescita delle colture micro-algali
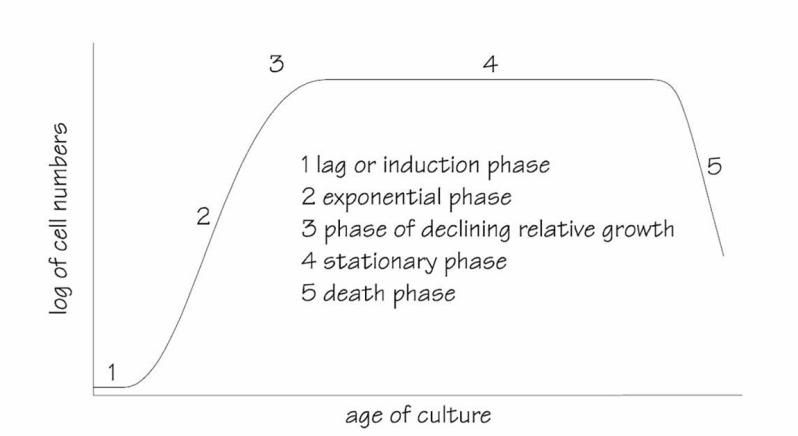 2) fase esponenziale
2) fase esponenziale: durante la seconda fase, la densità cellulare aumenta in funzione del tempo t secondo una funzione logaritmica:
Ct = C0.emt
Dove Ct e Co sono la concentrazione cellulare al tempo t e o, e m = specifico rateo di crescita Lo specifico rateo di crescita dipende dalla specie algale, dall’intensità luminosa e dalla temperatura.
3) fase di declino del rateo di crescita: la divisione cellulare rallenta quando i nutrienti, la luce, il pH, la CO2 o altri fattori fisici/chimici cominciano a limitare la crescita.
4) fase stazionaria: nel quarto stadio, i fattori limitanti e il rateo di crescita sono equilibrati, pertanto la densità cellulare rimane relativamente costante.
5) morte o fase di “crash”: durante la fase finale, la qualità dell’acqua peggiora e i nutrienti sono esauriti e incapaci di sostenere la crescita. La densità cellulare diminuisce rapidamente e la coltura collassa.
In pratica il crash della coltura può essere causato da diverse ragioni: l’esaurimento dei nutrienti, mancanza di ossigeno, surriscaldamento, pH o contaminazione. La chiave di successo della produzione algale è mantenere tutte le colture nella fase esponenziale di crescita. Inoltre, i valori nutrizionali delle alghe prodotte sono inferiori una volta che la coltura raggiunge la fase 3, a causa della ridotta digeribilità, deficienza di composizione e possibili produzioni di metaboliti tossici.
2.3.3. Isolare, ottenere e mantenere la coltura
Le colture sterili di micro-alghe usate per l’acquacoltura devono essere ottenute da specifiche raccolte di colture. Alternativamente può essere considerata l’isolamento di specie endemiche. Tale isolamento delle specie algali non è semplice a causa delle loro piccole dimensioni. Molte tecniche di laboratorio sono disponibili per isolare cellule individuali, come colture seriali diluite e successivamente riposte in vitro e separate usando pipette capillari. I batteri possono essere eliminati dalle colture utilizzando antibiotici.
La raccolta di specie algali deve essere protetta con cura dalla contaminazione durante la manipolazione e mantenendo una bassa temperatura. Per ridurre i rischi, due serie dello stesso campione vengono stoccate: una viene utilizzata come starter di nuove colture per il sistema di produzione e l’altra viene utilizzata solo in caso di necessità. Le colture stoccate sono mantenute in provette, sottoposte ad un’intensità luminosa di 1000 lux e ad una temperatura di 16°/19°. L’illuminazione costante serve a mantenere i flagellati, ma per le colture di diatomee può comportare una riduzione delle dimensioni cellulari. Le colture stoccate vengono conservate per un mese e poi trasferite per creare nuove colture.
2.3.4. Fonti di contaminazione e trattamento dell’acqua
La contaminazione di batteri, protozoi e altre specie di alghe è un problema serio per la coltura monospecifica/axenica. La più comune fonte di contaminazione include il materiale di coltura (acqua marina e nutrienti), l’aria (attraverso l’aeratore e l’ambiente), il contenitore e la coltura “starter”.
L’acqua di mare usata per la coltura dovrebbe essere priva di organismi che possono competere con le alghe unicellulari, come altre specie di fitoplancton, zooplancton fitofago, batteri. La sterilizzazione dell’acqua di mare sia fisica (filtrazione, autoclave, pastorizzazione, irradiazione UV) sia chimica (clorazione, acidificazione, ozonizzazione) è pertanto necessaria. L’autoclave (da 15 a 45 minuti a 120° a 20 psi, a seconda del volume) o la pastorizzazione (80° per 1-2 ore) sono molto utilizzate in provette, fiaschi erlenmeyer e damigiane. I volumi maggiori di 20 litri sono generalmente filtrati a 1μm e trattati con acido o cloro.
Il trattamento dell’acqua non è necessario quando si usa acqua salata sotterranea estratta dal suolo. Quest’acqua è generalmente priva di organismi viventi e contiene sufficienti sali minerali per supportare la coltura senza ulteriori integrazioni. In alcuni casi l’acqua di pozzo contiene alti livelli di ammonio e sali ferrosi, che successivamente precipitano dopo l’ossidazione a contatto con l’aria.
 Figura 2.4. Stanza a temperatura controllata per il mantenimento di colture di stoccaggio in un vivaio di molluschi bivalvi: colture stoccate in provetta (sinistra) e cappa d’inoculo (destra)
Figura 2.4. Stanza a temperatura controllata per il mantenimento di colture di stoccaggio in un vivaio di molluschi bivalvi: colture stoccate in provetta (sinistra) e cappa d’inoculo (destra)
Una fonte comune di contaminazione è la condensa nei tubi dell’aria con ciliati. Per questa ragione i tubi dell’aria vanno mantenuti asciutti e sia l’aria che la CO2 vanno filtrati attraverso un filtro in linea da 0,3 o 0,5 μm prima di essere introdotti nella coltura. Per grandi volumi d’aria, le unità di filtro possono essere costruite con cotone e carbone.
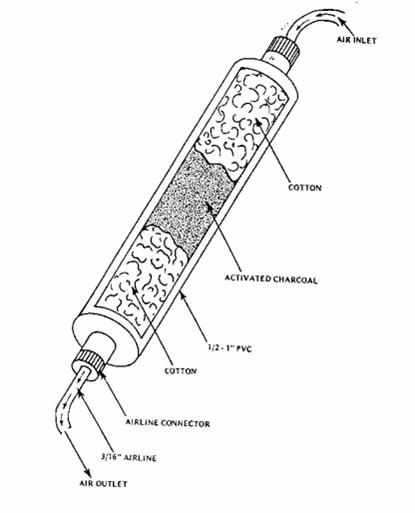 Figura 2.5. Filtro per l’areazione
Figura 2.5. Filtro per l’areazione
La preparazioni di piccoli contenitori per la coltura è una passaggio essenziale per il successo della coltura algale:
- Lavare con detergente
- Sciacquare in acqua calda
- Lavare con acido muriatico 30%
- Sciacquare ancora in acqua calda
- Asciugare prima dell’uso
In alternativa, provette, fiaschi e damigiane possono essere sterilizzati con autoclave oppure utilizzare contenitori usa e getta o sacchi in polietilene.
2.3.5. Tecniche di coltura algale
Le alghe possono essere prodotte usando una grande varietà di metodi, partendo da metodi di laboratorio altamente controllati ad altri meno ortodossi in vasche mantenute all’aperto. La terminologia usata per descrivere il tipo di coltura algale è:
- Al chiuso/all’aperto. Le colture al chiuso permettono il controllo dell’illuminazione, temperatura, livelli di nutrienti, contaminazioni da predatori e alghe estranee; mentre per i sistemi mantenuti all’aperto è molto difficile mantenere la crescita algale per periodi prolungati.
- Aperto/Chiuso. Le colture aperte sono allestite in laghetti scoperti e vasche (al chiuso o all’aperto) e sono più frequentemente contaminate rispetto a quelle chiuse nelle provette, fiaschi, damigiane, sacchi, ecc..
- Axenico(=sterile)/xenico. Le colture axeniche sono prive di ogni organismo estraneo e batterio; richiedono un’attenta sterilizzazione della vetreria, materiale di coltura e contenitori. Può rivelarsi poco pratica per le operazioni commerciali.
- Serie, continua o semi-continua. Queste sono le tre tipologie di base della coltura di fitoplancton che saranno descritte nelle prossime sezioni
2.3.5.1. Coltura in serie
La coltura in serie consiste in un singolo inoculo di cellule in un contenitore di acqua salata fertilizzata, seguita da un periodo di crescita che dura diversi giorni e raccolta solo quando la popolazione algale raggiunge la sua densità massima. In pratica le alghe sono trasferite in colture di volume maggiore prima di raggiungere la fase stazionaria, quindi portata nuovamente alla massima densità e raccolta. La progressione usata nei vari stadi è: 1 provetta, fiasco da 2 litri, damigiane prima da 5 poi da 20 litri, cilindri da 160 litri, vasche al coperto da 500litri , vasche all’aperto da 5000 fino a 25000 litri.
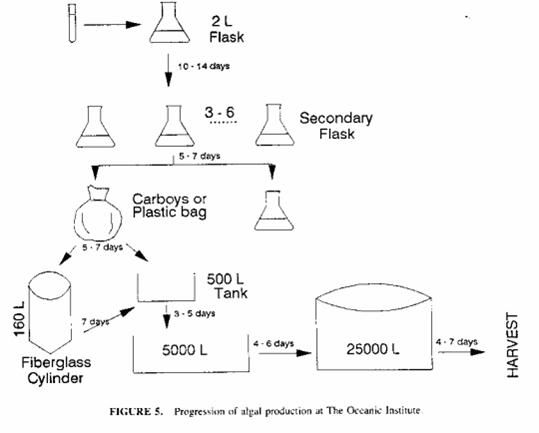 Figura 2.6. Schema di produzione di una coltura in serie
Figura 2.6. Schema di produzione di una coltura in serie
A seconda della concentrazione algale, il volume dell’inoculo generalmente corrisponde al volume del precedente stadio della progressione, e circa il 2 – 10% del volume della coltura finale. Quando è necessaria una piccola quantità di alghe, il metodo più semplice di colture al chiuso impiega damigiane in vetro o plastica da 10-20 litri., che possono essere riposte su dei ripiani e illuminati con dei neon (figura 2.9.).
Grazie alla sua semplicità e flessibilità, il sistema di coltura in serie è ampiamente utilizzato e permette di cambiare specie e rimediare ad eventuali errori molto rapidamente. Anche se spesso è considerato come uno dei metodi più affidabili, non sempre è il più efficiente. Le colture in serie sono raccolte appena prima dell’inizio della fase stazionaria e di conseguenza bisogna sempre mantenerle per un sostanziale periodo di tempo dopo il massimo rateo di crescita. Inoltre, la qualità delle cellule raccolte può essere meglio prevedibile rispetto a un sistema continuo chee per esempio può variare a seconda del momento esatto della raccolta.
Un altro svantaggio è il bisogno di prevenire la contaminazione durante il primo inoculo e il primo periodo di crescita. Visto che la densità di fitoplancton necessaria è molta bassa e la concentrazione di nutrienti alta, ogni agente contaminante può velocemente proliferare e portare la coltura in fase di crash. La coltura in serie richiede inoltre tantissimo lavoro per la raccolta, pulizia, sterilizzazione, riempimento e inoculo dei contenitori.
 Figura 2.7.a. Sistema di coltura in serie per la produzione di massa di micro-alghe in vasche da 20'000 litri.
Figura 2.7.a. Sistema di coltura in serie per la produzione di massa di micro-alghe in vasche da 20'000 litri.
 Figura 2.7.b Sistema di coltura in serie per la produzione di massa di micro-alghe in cilindri da 150 litri.
Figura 2.7.b Sistema di coltura in serie per la produzione di massa di micro-alghe in cilindri da 150 litri.
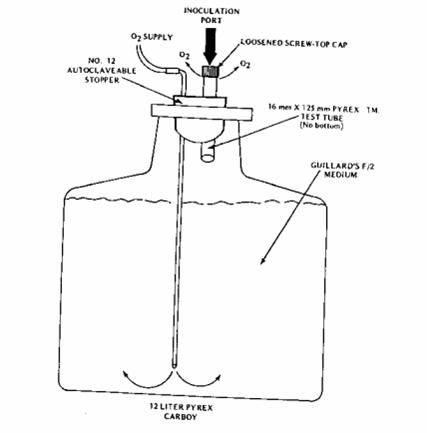 Figura 2.8. Apparato di coltura in damigiana
Figura 2.8. Apparato di coltura in damigiana
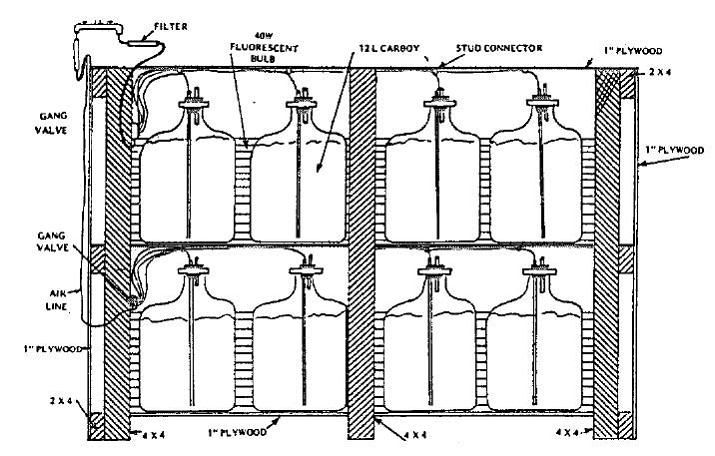 Figura 2.9. Coltura in damigiane su ripiani
2.3.5.2 Coltura continua
Figura 2.9. Coltura in damigiane su ripiani
2.3.5.2 Coltura continua
Il metodo di coltura continua è un sistema in cui un supplemento di acqua salata fertilizzata viene continuamente pompata all’interno delle camere di crescita mentre la coltura in eccesso è simultaneamente espulsa; permette il mantenimento della coltura molto vicino al massimo rateo di crescita. Si possono distinguere due categorie di coltura continua :
- Coltura turbidostat, in cui la concentrazione algale è mantenuta ad un determinato livello diluendo la coltura con nuovo materiale grazie ad un dispositivo automatico
- Coltura chemostat, in cui un flusso costante di nuovo liquido di coltura viene introdotto nelle camere di crescita. Il liquido fresco in entrata aggiunge alla coltura un limitato livello di nutrienti (nitrati) e in questo modo è il livello di crescita a rimanere costante e non la densità cellulare.
Laing ha descritto la costruzione e il funzionamento di un sistema continuo da 40 litri adatto alla coltura di flagellati, Tetraselmis suecica e Isochrysis galbana. I contenitori sono costituiti da tubi in polietilene illuminati dall’interno e supportati da una rete metallica (Figura 2.11.). Questo sistema turbidostat produce 30-40 litri al giorno con una densità cellulare ottimale per ogni specie di flagellati. Un sistema chemostat, che è relativamente semplice ed economico da costruire, è utilizzato dalla Seasalter Shellfish Co. Ltd, UK (Figura 2.12.). Questa ditta impiega sacchi in polietilene verticali da 400 litri per coltivare Pavlova lutheri, Isochrysis galbana, Tetraselmis suecica, Phaedoctylum tricornutum, Dunaliella tertiolecta, Skeletonema costatum. L’inconveniente di questo sisistema è il diametro dei sacchi (60 cm) che risulta controproducente per l’illuminazione e provoca una bassa densità algale.
Gli svantaggi di un sistema continuo sono la complessità e gli alti costi di gestione. La necessità di illuminazione e temperatura costanti obbliga l’ubicazione di tali impianti all’interno di fabbricati e questo è diventa fattibile solo per produzioni relativamente piccole. Tuttavia, le colture continue hanno il vantaggio di produrre alghe con una qualità più controllata; inoltre sono gestite da controlli ed automazioni tecnologiche, che incrementano l’affidabilità del sistema e riduce la manodopera.
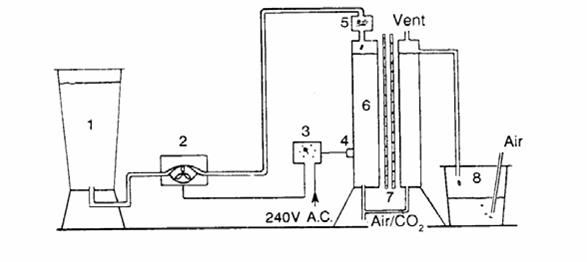 Figura 2.10. Diagramma di un apparato di coltura continua: (1) riserva di acqua salata (200l); (2) pompa peristaltica; (3) resistenza elettrica (ORP 12); (5) filtro a cartuccia (0,45 μm); (6) contenitore della coltura (40l); (7) sei neon 80w.
Figura 2.10. Diagramma di un apparato di coltura continua: (1) riserva di acqua salata (200l); (2) pompa peristaltica; (3) resistenza elettrica (ORP 12); (5) filtro a cartuccia (0,45 μm); (6) contenitore della coltura (40l); (7) sei neon 80w.
 Figura 2.12. Coltura continua di micro alghe in sacchi di plastica.
2.3.5.3. Coltura semi-continua
Figura 2.12. Coltura continua di micro alghe in sacchi di plastica.
2.3.5.3. Coltura semi-continua
La tecnica semi-continua impiega l’uso di grandi vasche in cui la coltura viene periodicamente raccolta ed immediatamente riempita con nuova acqua arricchita di nutrienti e portata al volume originale; una volta che la coltura è cresciuta nuovamente, viene parzialmente raccolta, etc. Le colture semi-continue possono essere installate sia al chiuso che all’aperto, ma la loro durata non è pianificabile. I competitori, predatori e/o i contaminanti e metaboliti eventualmente infiltrati, rendono la coltura inadatta all’uso prolungato. Finché la coltura non è stata raccolta completamente, il metodo semi-continuo produce più alghe del metodo in serie (a parità di grandezza delle vasche).
2.3.6. Produzione algale in laghetti all’aperto
Grandi laghetti all’aperto, sia quelli con fondali naturali o cemento, sia quelli con pareti in polietilene o PVC, sono molto efficaci per la produzione algale. Il materiale nutriente per le colture all’aperto è lo stesso di quello usato al chiuso, con la differenza che si tratta di fertilizzanti agricoli anziché reagenti da laboratorio (Tabella 2.5.). In ogni modo, la fertilizzazione di colture algali di massa in laghetti d’estuario e chiusi, usati per il mantenimento di molluschi bivalvi, non erano auspicabili quando i fertilizzanti, ancora troppo costosi, provocavano fioriture fluttuanti di alghe, che si traducevano in picchi di produzione seguiti da totali crash. Invece, le naturali fioriture vengono mantenute ad un livello accettabile di densità cellulare nel corso dell’anno e i laghetti vengono riempiti con acqua oceanica quando necessario. La profondità delle colture è solitamente di 0,25-1 m. Le colture provenienti dalla produzione al chiuso servono per l’inoculo di colture mono-specie. In alternativa, si può introdurre una fioritura di fitoplancton di acqua di mare dopo esser stata privata di tutto lo zooplancton presente, mediante un filtraggio a sabbia. La produzione algale nei laghetti all’aperto è relativamente economica, ma è adatta solo per alcune specie dalla crescita veloce, a causa dei problemi di contaminazioni dei predatori, parassiti e “malerba” acquatica. Inoltre, la produzione all’aperto è spesso caratterizzata da scarsa costanza di specie ed è altamente inaffidabile a causa dei cambi meteorologici e della qualità dell’acqua.
2.3.8. Quantificare la biomassa algale
Esistono diversi modi per valutare la quantità di biomassa algale presente nelle colture: conteggio del numero di cellule in un determinato volume, densità ottica e peso.
Le cellule possono essere contate sia con un conteggio elettronico o direttamente con un microscopio usando un emocitometro. Oppure si può stabilire una relazione tra la densità ottica e la concentrazione cellulare, usando uno spettrometro.
Tuttavia, misurare il peso a secco di una coltura è uno dei più diretti metodi per stimare la produzione di biomassa. Per questo, le cellule di un campione è separato dal materiale di coltura attraverso la centrifuga o filtrazione mediante un filtro a fibre di vetro. Le cellule delle alghe marine vengono quindi lavate con del formiato di ammonio (0,5 M) per rimuovere i sali senza che le cellule si danneggino. Il formiato di ammonio non lascia alcun residuo visto che si decompone in elementi volatili durante il processo di asciugatura (2 ore a 100°). Il risultato si può definire come peso a secco per volume.
Per alcune particolari specie algali, il peso a secco per cellula può cambiare sensibilmente a seconda del tipo e delle condizioni della coltura. Tuttavia la densità delle alghe generalmente raccolte oscilla tra gli 80 e i 250 mg per litro.
2.3.9. Raccolta e stoccaggio delle micro-alghe
In alcuni casi, non è necessario separare le micro-alghe dal fluido di coltura, tuttavia le eccedenze e le produzioni “fuori-stagione” vanno concentrate e preservate. Le varie tecniche impiegate per la raccolta delle micro-alghe sono state elencate da Fox e Bernabè. Colture algali ad alta densità possono essere concentrate sia attraverso flocculazione chimica che con centrifuga. Prodotti come solfato d’allumino e cloruro ferrico causano alle cellule un coagulo e la precipitazione sul fondo o la galleggiabilità in superficie. A quel punto basterà sifonare il fondo o schiumare le cellule dalla superficie. A causa delle maggiori dimensioni delle particelle, le alghe coagulate non sono più adatte a nutrire animali filtratori.
La centrifuga di grandi volumi di alghe è solitamente eseguita con dei separatori e la velocità è scelta in base al tipo ti alghe da trattare. Le cellule depositate sulle pareti formano una pasta algale che viene poi riposta in un piccolo volume d’acqua. Il prodotto a questo punto può essere stoccato per 1-2 settimane nel frigorifero o nel congelatore (in questo caso, agenti cryoprotettivi vengono aggiunti per mantenere l’integrità cellulare durante il congelamento. Tuttavia, lo sconvolgimento delle cellule e la limitata durata di conservazione rimangono i maggiori svantaggi dello stoccaggio delle alghe. Colture concentrate di Tetraselmis suecica rimaste al buio a 4° mantengono la loro vitalità, mentre la perdono completamente se congelate.
2.4. Valori nutrizionali delle micro-alghe
Il valore nutrizionale di ogni specie algale per un particolare organismo dipende dalle dimensioni della cellula, produzione di composti tossici e composizione chimica. Le composizioni di 16 specie di micro-alghe sono comparate nella tabella 2.12. Nonostante ci siano delle evidenti differenze nella composizioni delle varie classi e specie di micro-alghe, le proteine sono sempre il maggiore costituente organico, seguito solitamente dai lipidi e dai carboidrati. Esprimendo i valori in percentuali (peso a secco), il range dei livelli di proteine, lipidi e carboidrati sono rispettivamente 12-35%, 7,2#23%, 4,6#26%.
Il contenuto dei acidi grassi HUFA (EPA, ARA e DHA) è di primaria importanza nella valutazione della componente nutrizionale delle varie specie di micro-alghe usate come cibo per gli organismi marini. Concentrazioni significative di EPA sono presenti nelle diatomee (Chaetoceros calcitrans, C. gracilis, S. costatus, T. pseudonana) e nelle primnesiofite Platymonas lutheri, mentre alte concentrazioni di DHA si possono trovare nelle primnesiofite (P. lutheri, Isochrysis spp.) e nella Chroomonas salina.
Le micro-alghe sono anche considerate come una ricca fonte di acido ascorbico (0,11 – 1,62% del peso a secco).
Il valore nutrizionale può variare a seconda delle condizioni della coltura.
E’ stato dimostrato che la proteina contenuta in ogni cellula, che è il fattore più determinante per valore nutrizionale, è molto più suscettibile alla variazione media indotta rispetto altri costituenti della cellula.
Tabella 2.12. Concentrazioni di clorofilla a, proteine, carboidrati e lipidi in 16 specie di micro-alghe comunemente usate in acquacoltura
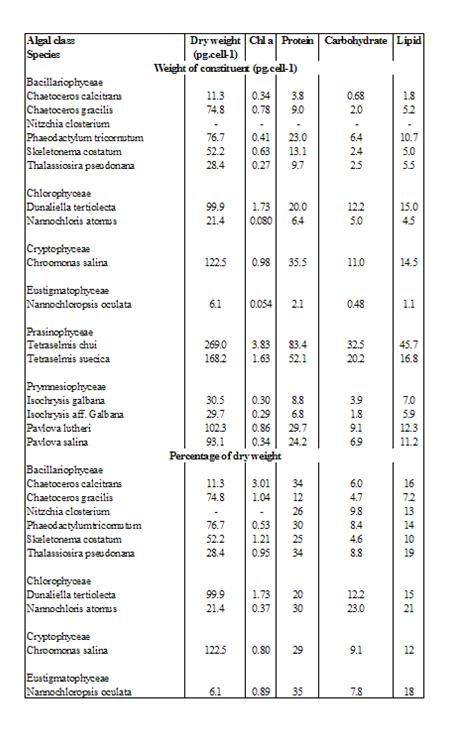
La crescita degli animali nutriti con un mix di diverse specie algali è spesso maggiore rispetto a quella ottenuta nutrendo con una sola specifica specie di micro-alghe. Infatti una particolare alga può essere carente di un certo nutriente che invece un’altra può esserne ricca. In questo modo, il mix di entrambe le specie fornisce agli animali l’adeguata quantità di entrambi i nutrienti.
2.5. L’uso delle micro-alghe in acquacoltura
Le micro-alghe sono una risorsa di cibo essenziale per l’allevamento di tutti i molluschi bivalvi marini (vongole, ostriche, capesante), degli stadi larvali di alcuni gasteropodi marini (orecchie di mare), delle larve di svariate specie di pesci marini e gamberi peneidi e dello zooplancton.
2.5.2. Gamberi peneidi
Le alghe vengono aggiunte nelle vasche sin dallo stadio di nauplio (quando ancora non si alimenta) per fare in modo che siano subito disponibili non appena avviene la mutazione a stadio protozoico. Le specie algali solitamente usate sono: Tetraselmis chui, Chaetoceros gracilis e Skeletonema costatum. Quando avviene il cambio di preferenza di cibo (mutazione da erbivoro a carnivoro durante lo stadio mysis) la quantità di alghe viene ridotta. Tuttavia, un basso livello di quantità di alghe viene mantenuto per stabilizzare la qualità dell’acqua. Il metodo “stessa vasca”, che comporta la coltivazione delle alghe nella stessa acqua in cui si allevano le larve utilizzando luce solare e fertilizzanti, è stato sviluppato in Giappone per l’allevamento delle larve di Penaeus japonicus.
2.5.3. Pesci marini
A parte la necessità di microalghe per l’allevamento e l’arricchimento degli organismi-preda come Artemia e rotiferi, le alghe sono spesso versate direttamente nell’acqua delle vasca per l’allevamento delle larve. Questa “tecnica dell’acqua verde” fa parte della tecnica di allevamento delle larve di orata Sparus aurata (50'000 cellule per ml di Isochrysis sp. + 400'000 cellule per ml di Chlorella sp. al giorno), per i Chanos chanos (da 500 a 3'500 cellule per ml per i primi ventuno giorni), ecc.
Gli effetti della presenza di micro-alghe nelle vasche d’allevamento delle larve non sono ancora state comprese appieno e includono:
- Stabilità della qualità dell’acqua in sistemi di allevamento statici (rimuovono i sottoprodotti metabolici, producono ossigeno);
- Fonte diretta di cibo attraverso l’assunzione dei polisaccaridi presenti nelle pareti cellulari delle alghe che stimolano il sistema immunitario delle larve;
- Fonte indiretta di nutrienti per le larve attraverso il cibo vivo (mantengono alti i valori nutrizionali degli organismi-preda viventi presenti nelle vasche);
- Aumento dell’incidenza di cattura del cibo esaltando il contrasto visivo e la dispersione luminosa;
- Controllo microbico degli essudati algali nell’acqua delle vasche e/o nel intestino delle larve.
2.6. Sostituzione del regime alimentare basato su alghe vive
Gli alti costi dovuti alla produzione algale, i rischi di contaminazione e le variazioni repentine dei valori nutrizionali del cibo algale causano continui problemi alle operazioni di acquacoltura basate sulle colture di massa di alghe unicellulari. Per superare o ridurre i problemi e limitazioni dovuti a queste tecniche, vari ricercatori hanno tentato di sostituire le alghe a cibi artificiali sia per le integrazioni che per le principali fonti di cibo. Pertanto sono stati applicati svariati metodi per ridurre il fabbisogno di produzione algale in loco: conservazione delle alghe, prodotti micro-incapsulati e cibi a base di lievito.
In questo modo il fabbisogno di alghe vive nelle grandi produzioni di organismi-preda è stato sensibilmente diminuito. A tale scopo diete a base di lievito di birra, lieviti marini e lievito arricchito con lipidi, sono comunemente usati come dieta principale o in combinazione con l’alga Chlorella per l’allevamento dei rotiferi B. plicatis. Inoltre, sono stati fatti dei progressi considerevoli nella sostituzione delle alghe vive per l’allevamento di importanti specie di gambero, sostituendo parte della dieta a base di alghe con cibi micro-incapsulati e a base di lievito. La completa sostituzione con cibi micro-incapsulati, per l’allevamento di varie specie penide, viene effettuata filtrando l’acqua marina con filtri da 5 μm, che eliminano le alghe ma non i batteri che invece sembra che apportino importanti micronutrienti e immunostimolanti.
Negli allevamenti di pesci marini, la tendenza è quella di applicare la “tecnica dell’acqua chiara” al posto della “tecnica dell’acqua verde”, anche se l’omissione delle alghe nelle vasche contenenti le larve, che di conseguenza richiede un’ottimizzazione della strategia alimentare e degli aspetti zootecnici, provocano una certa inaffidabilità del risultato della produzione.
Infine nonostante gli sforzi della ricerca, l’uso di nutrimenti artificiali nelle colture di molluschi bivalvi rimane comunque molto limitato.
I vantaggi e gli svantaggi di ognuna delle tre tecniche di sostitutivi della dieta a base di alghe sono brevemente discussi di seguito.
2.6.1. Alghe conservate
Una possibile alternativa alla coltura algale in loco potrebbe essere la distribuzione di alghe conservate e frutto di produzioni a basso costo effettuate in grandi strutture con condizioni climatiche ottimali e usando i sistemi di produzione più redditizi. La centrifuga di alghe sotto forma di pasta conseguentemente congelata fino al momento dell’utilizzo, è una tecnica ampliamente utilizzata in Nord America per l’allevamento delle ostriche grazie a tecniche di controllo automatizzate.
Tuttavia le brevi scadenze e i prezzi alti di queste paste algali (200 dollari o più per ogni kg pesato a secco) scoraggiano molti allevatori. Recentemente, gli sviluppi sulle tecniche di conservazione hanno permesso di allungare la durata della conservazione dei concentrati di Thalassiosira pseudonana da 10 giorni a più di un anno. Le grandi strutture di produzione in laghetti all’aperto hanno portato ad una disponibilità di massa di un numero limitato di cibi a base di alghe, come Spirulina atomizzata e estratti atomizzati di Dunaliella salina. Quest’ultima può essere usata anche come supplemento alle alghe vive per aumentare la crescita delle larve di organismi bivalvi.
Inoltre, recenti tecniche hanno sviluppato per la produzione in larga scala di micro-alghe marine sotto condizioni di crescita eterotrofa, l’utilizzo di carbonio organico come risorsa di energia, al posto della luce. Le colture di alghe eterotrofe possono realizzare densità algali 1'000 volte superiori rispetto alle colture foto-autotrofe che possono essere conservate grazie all’atomizzazione. I costi previsti per la produzione algale in fermentatori industriali va dai 5 ai 25 dollari per chilo. Purtroppo, le tecniche di produzione di massa eterotrofe sono state realizzate per poche specie algali, e molte delle specie conosciute per avere alti valori nutrizionali (Chaetoceros, Isochrysis, Skeletonema, thalassiosira, Monochrysis) non sono in grado di crescere al buio. Inoltre le condizioni eterotrofe causano un drastico cambio nella composizione di massa e contengono meno HUFA rispetto alle alghe cresciute con la luce. Malgrado ciò, i prossimi sviluppi di questa tecnica, piuttosto recente, potrebbero migliorarne in futuro le loro composizioni biochimiche e il range di specie algali coltivabili con questo sistema.
2.6.2. Cibi micro-incapsulati
Grazie alla tecnica della micro-incapsulazione, vari ingredienti alimentari possono essere inseriti in capsule digeribili e ciò permetterebbe agli organismi che si alimentano di cibi in sospensione di alimentarsi senza che i nutrienti si disperdano nell’acqua. I problemi che potrebbero verificarsi con l’uso di questo tipo di cibo includono la sedimentazione, l’accumulo e la degradazione batterica delle particelle, la perdita di nutrienti e la scarsa digeribilità dell’involucro delle capsule.
2.6.3. Cibi a base di lievito
Grazie all’adatta dimensione e all’alta stabilità nella colonna d’acqua, i lieviti possono essere facilmente rimossi dal materiale in sospensione e ingeriti facilmente dagli organismi filtratori. Inoltre, a differenza di molte delle alternative alle alghe vive, il lievito può essere prodotto in larga scala ad un costo relativamente basso. Il potenziale del lievito usato come nutrimento in acquacoltura, si è rivelato adatto all’allevamento di rotiferi ed alcune specie di gamberi penidi.
Tuttavia, il valore nutrizionale del lievito si è rivelato insufficiente per l’alimentazione di alcune specie di organismi filtratori.
In ogni caso, il valore nutrizionale e la digeribilità dei cibi a base di lievito può essere migliorata con l’integrazione di nutrienti essenziali e trattamenti chimici alle pareti cellulari. In questo modo, circa il 50% delle alghe utilizzate può essere sostituito con cibi a base di lievito con minimi effetti sulla crescita delle vongole (in stadio juvenile) Mercenaria mercenaria.